丂丂偙偺崌嬥栺侾侽侽倗傪楻搇偵擖傟偰嬻拞偱曻椻偟偨椻媝嬋慄傪應掕偡傞偲丄傎傏堦掕偺嫟徎壏搙偱偁傝丄昞柺偼屌傑偭偰傕撪晹偼俀侽暘嬤偔傕塼憡偑巆偭偰壏搙偑曄傢傜側偐偭偨丅
丂丂乮倐倷丏丂俁丏掅壏堟偺婰榐壏搙寁丗丂嬅屌帪朿挘偡傞偺偱僙儞僒偵偼僔儕僐儞僑儉娗傪偐傇偣丄僄億僉僔偱暍偭偨丅 拞怱傛傝奜懁偵抲偄偨偺偱 俀亅俁亷掅傔偺應掕抣偲側偭偨丅乯
丂

丂
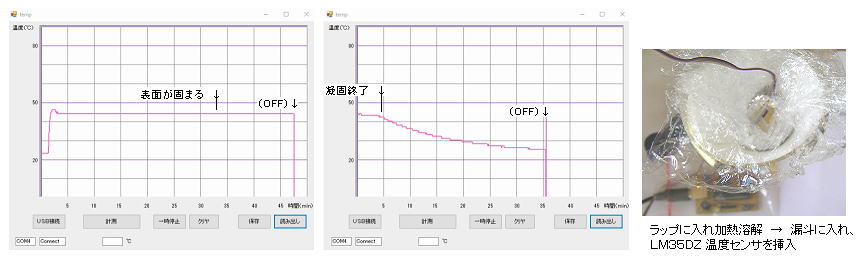
丂丂丂俀丏丂僈儕僂儉偺揹夝幚尡丗
丂丂偟偽傜偔乮俁侽擭丠乯庢偭偰偍偄偨 僈儕僂儉丒僀儞僕僂儉崌嬥乮恀嬻僗僷僢僞儕儞僌丒僞乕僎僢僩偺愙拝梡丄巁壔偟傗偡偄乯偑偁偭偨偺偱丄傆偨傪奐偗偰傒傞偲 巁壔暔偵嬥懏偑偟傒崬傫偱僗億儞僕忬偵側偭偰偄偨丅僈儕僂儉偼丄乽擥傟惈乿偑旕忢偵嫮偔丄懡偔偺傕偺偵偟傒偙傫偱晅拝偡傞丅柍撆偱偼偁傞偑丄庤偵拝偔偲崟偔側偭偰庢傟偵偔偄丅乮僗僉乕梡偺僈儕僂儉丒儚僢僋僗偺梡搑偑偁傞乯
丂丂傑偨僈儕僂儉偼丄懡偔偺嬥懏乮俙倢丄倅値丄俠倳丄俶倝丄俙倗丄俹倲丄俥倕側偳傕乯偲崌嬥傪嶌傞丅揝偲偺崌嬥偼 帴惈懱偲偟偰梡偄傜傟傞丅
丂丂偦偙偱傑偢丄侾侽亾偔傜偄偺悈巁壔僇儕僂儉梟塼傪壛偊偰壏傔丄梟偗側偄巁壔暔乮巁壔僀儞僕僂儉偑儊僀儞乯偲嬥懏晹傪暘棧偟偨丅
丂丂師偵丄偦偺僀儞僕僂儉丒僈儕僂儉崌嬥傪僗僥儞儗僗梕婍偵擖傟丄俲俷俫偵悈傪彮偟壛偊偨夁忚偺擹悈巁壔僇儕僂儉梟塼偲壛擬乮傾儖僇儕壛擬婋尟丄婄柺曐岇嬶傪拝偗傞乯偟偰僗僥儞儗僗偝偠偱傛偔奾漚偟丄僈儕僂儉偺傒傪 僈儕僂儉巁僇儕僂儉偺宍偵斀墳偝偣偰丄傾儖僇儕偲斀墳偟偵偔偄僀儞僕僂儉偐傜暘棧偡傞丅乮俀亅俁夞 悈傪彮検壛偊偰壛擬偡傞偙偲傪孞傝曉偡乯丂梕婍偺掙偵偼枹斀墳偺僀儞僕僂儉丒儕僢僠偵側偭偨崌嬥偑巆傞丅丂偙傟傪悈偱拪弌偟偰丄僈儔僗僼傿儖僞乕偱媧堷傠夁偡傞偲丄柍怓摟柧偺塼偲側傝丄栺俀侽侽倣倢偲偡傞丅
丂丂丂丂丂丂俀 俧倎丂亄丂俇 俲俷俫丂亄丂俇 俫2俷丂仺丂俀 俲3乵俧倎乮俷俫乯6乶丂亄丂俁 俫2 仾
丂丂僈儕僂儉偼斱側嬥懏偱偁傞偵傕偐偐傢傜偢丄悈慺夁揹埑偑斾妑揑崅偄偺偱丄垷墧側偳偲摨條偵巁惈梺偐傜偱傕愅弌偡傞丅偙偙偱偼丄俲俷俫偑懡検偵崿偠偭偨丄嫮傾儖僇儕梺偐傜揹愅偡傞丅
丂丂拪弌塼傪俀侽侽倣倢偺僩乕儖價乕僇乕偵擖傟丄梟梈僈儕僂儉偲斀墳偟側偄 儌儕僽僨儞朹乮冇俁倣倣乯傪 堿嬌丄 敀嬥亅僗僥儞儗僗儊僢僔儏傪 梲嬌偲偟偰丄侾俀倁俆俙偺僗僀僢僠儞僌揹尮傪捈愙梡偄偰丄俁乣俆俙丄儌儕僽僨儞揹嬌偺怹捫挿侾亅俁倣倣丄嬌娫嫍棧俁們倣 偱丄栺俇帪娫揹夝偟偨丅 梟塼偼敪擬偟丄忲敪偡傞偺偱丄揹嬌傪彊乆偵壓偘傞丅
丂丂儌儕僽僨儞朹堿嬌偵愅弌偟偨僈儕僂儉偼丄塼揌偲側偭偰價乕僇乕偺掙偵偨傑傞丅丂乮仏丂悈慺偲巁慺偑摨帪偵敪惗偡傞偺偱丄僗僷乕僋摍偺堷壩偵傛傞敋敪拲堄丒僼儔僗僐偺傛偆側暵偠偨梕婍偱偼傗傜側偄偙偲乯丂揹夝偑恑傫偱僈儕僂儉擹搙偑敄偔側傞偲丄悈慺偽偐傝敪惗偟偰揹夝岠棪偑壓偑傞丅
丂丂偱偒偨僈儕僂儉嬥懏乮梈揰 俀俋丏俈俉亷乯偼夁椻媝偡傞偺偱丄昘椻偵傛偭偰屌壔偝偣傞丅乮偳偆偟偰傕僀儞僕僂儉偑懡彮崿偠偭偰梈揰偑壓偑傞丅乯
丂丂丂丂丂丂乵俧倎乮俷俫乯6乶3亅倎倯丂亄丂俁 倕亅丂仺丂俧倎 伀丂亄丂俇 俷俫亅倎倯丂丂丂丂乮傾儖僇儕悈梟塼拞乯
丂

丂丂丂俁丏丂揝偺揹夝幚尡丗
丂丂俀壙偺揝僀僆儞俥倕俀亄偼丄俁壙偺揝僀僆儞俥倕俁亄傛傝傕 峀偄倫俫偺斖埻偱埨掕偱丄悈巁壔暔傪捑揳偟偵偔偄丅堦曽丄巁惈傪憹偡偲丄堿嬌偐傜悈慺偽偐傝弌偰岠棪偑棊偪傞丅丂棸巁揝乮嘦乯偵摍検偺棸巁傾儞儌僯僂儉傪壛偊偨暔乮亖屌懱偱偼儌乕儖墫 乮俶俫4乯2俥倕乮俽俷4乯2丒俇俫2俷乯偼丄棸巁傾儞儌僯僂儉偑倫俫偺娚徴嵻偲側偭偰暘愅帋栻偵梡偄傜傟傞傎偳埨掕偡傞丅 乮揝揹夝偺幚尡丗 嶲峫乯
丂丂俥倕俽俷4丒俈俫2俷 乮俈悈墫丄俵亖俀俈俉丏侽乯丂俀俉倗丄 乮俶俫4乯2俽俷4 乮侾俁俀丏侾乯丂侾係倗丂傪悈偵梟偐偟偰 俀侽侽倣倢偲偟丄俀侽侽倣倢偺僩乕儖價乕僇乕偵擖傟傞丅丂倫俫傪應傞偲丄俁丏俇俆 偩偭偨丅
丂丂梲嬌偼丄揝慄乮冇丏俈丄愗傟傗偡偄偺偱傕偭偲懢偄慄偺傎偆偑椙偄乯傪 偁傜偐偠傔婓棸巁偵捫偗偰昞柺偺垷墧倅値傔偭偒傪偼偑偟丄偖傞偖傞姫偒偵偡傞丅丂堿嬌偼埨壙側扽慺朹偲偟偨丅乮愅弌偟偨揝傪庢傝弌偟傗偡偄 敄偄僗僥儞儗僗偱傕椙偄丅扽慺偑崿偠傜側偄丅乯
丂丂揹夝忦審偼丄丂倫俫乮弶婜乯俁丏俇俆丄丂嬌娫 倓佮俁們倣丄丂堿嬌偺僇乕儃儞 冇侾們倣丄怹捫挿 俇們倣丂亪丂侾俋們倣2 亖 侽丏侾俋倓倣2丄揹棳侾俙偱 俆丏俁俙/倓倣2丄丂俀丏係乣俀丏俉倁丄侾丏侽 俙丄丂梺壏俀俆亷乮敪擬偼彫偝偄乯丄丂掅揹埑偱斾妑揑揹棳偑戝偒偔丄掞峈宆偺掕揹埑揹尮偱偼僩儔儞僕僗僞偺敪擬偑戝偒偄偺偱丄挿帪娫偺揹夝偵偼丄壜曄宆偺崀埑僗僀僢僠儞僌揹尮乮廐寧揹巕偺僉僢僩傪彮偟夵憿丄擖椡丗僗僀僢僠儞僌揹尮 侾俀倁俆俙丄弌椡丗侽丏俉倁乣俉倁丄倣倎倶 俆俙丄 敪擬偼彫偝偄丅乯傪梡偄偨丅丂堿嬌偐傜偼悈慺偑彮偟敪惗偡傞丅
丂丂俀帪娫敿屻丄梲嬌偺揝慄偑愗傟偨偺偱梲嬌傪晅偗懼偊丄傕偆俀帪娫揹夝偟偨丅丂偙偺帪揰偱 堿嬌偺扽慺朹偵偼 敿偽棻忬偺揝偑枾拝偟偰偄偨丅 揹棳傪侾丏俆俙埲忋偵偡傞偲晹暘揑偵惉挿偟丄攳棧偡傞偲傏傠傏傠偺棻偲側傞丅丂帴愇偵晅偔丅
丂丂乮仏丂揹拻偺傛偆側鉱枾側枌偲偡傞偨傔偵偼丄墫壔暔梺傪梡偄傞丅 乮俥倕俠倢2丂俀俀俆乣係俆侽倗丄丂俠倎俠倢2丂侾侾侽乣侾俆侽倗丂/侾侽侽侽倣倢丄丂俀乣俉俙/倓倣2丄丂倫俫亖侽丏侾俆乣侾丏俆丄丂俉俆乣俋俆亷乯乯
丂

丂丂丂係丏丂僥儖儈僢僩斀墳偺幚尡丗
丂丂乮侾乯丂揝僥儖儈僢僩
丂丂巁壔戞擇揝乮巁壔揝乮嘨乯乯 俥倕2俷3乮侾俆俋丏俉乯 偲丄傾儖儈僯僂儉暡枛 俙倢乮俀俈丏侽乯 傪丄儌儖斾傛傝彮偟俙倢傪懡傔偵偟偰乮俙倢偑摍検傑偨偼彮側偄偲斀墳偟側偄乯丄擕敨偱傛偔偡傝捵偟偰崿崌偟丄壛擬姡憞偟偰傞偮傏偵擖傟丄儅僌僱僔僂儉儕儃儞乮亄彮検偺墫慺巁僇儕乯偱揰壩偡傞偲丄寖偟偔斀墳偟偰崅壏偵側傝丄揝傪梀棧偡傞丅 偨偩偟丄揝偺梈揰偑崅偔乮侾俆俁俉亷乯丄側偐側偐梟梈偟側偄丅乮扽慺傪崿偤傞偲梈揰偼壓偑傞偑 拻揝乮梈揰侾俀侽侽亷埲壓乯偵側傞丅乯
丂丂丂丂丂丂俥倕2俷3丂亄丂俀 俙倢丂仺丂俀 俥倕丂亄丂俙倢2俷3
丂丂堦夞栚偼丄俥倕2俷3丂俇丏係倗丄丂俙倢丂俀丏俇倗丂傪傛偔崿崌偟偰丄壛擬姡憞乮俀侽侽亷掱搙乯偟偰丄晛捠偺帴惢傞偮傏乮俁侽們們乯偵擖傟偰丄乮壓偵愇塸嶮傪抲偒乯儅僢僼儖撪偵抲偒丄揰壩丅乮壓偵偼擮偺偨傔丄儃僂儖偵悈傪挘偭偰偍偔丅乯
丂丂擇夞栚偼丄俥倕2俷3丂侾俇倗丄丂俙倢丂俇丏俁倗丂傪傛偔崿崌偟偰丄壛擬姡憞乮俀侽侽亷掱搙乯偟偰丄摟柧愇塸偺傞偮傏乮俆侽們們乯偵擖傟偰丄摨條偵儅僢僼儖撪偵抲偒丄揰壩丅
丂丂偳偪傜傕丄撪梕暔偑悂偒旘傇傛偆側偙偲偼側偔丄斾妑揑埨慡偵幚尡偱偒偨偑丄彫棻忬丄偁傞偄偼丄暡枛忬偺揝偑偱偒偨丅乮嵱偄偰丄帴愇偱慖暿乯丂帴惢傞偮傏偼擬僔儑僢僋偱妱傟偨偑丄愇塸傞偮傏偼擬朿挘棪偑掅偔乮亖擬僔儑僢僋偵嫮偔乯妱傟側偄偱丄椻偊偰偐傜媡偝偵偟偰寉偔扏偔偲 撪梕暔偑弌偰偒偰丄傞偮傏偼嵞棙梡偱偒傞丅丂崱夞検偑彮側偄偺偲丄抐擬偑傛偔偱偒偰偄側偄偺偱偡偖椻傔偰偟傑偄丄揝偑棳摦偡傞傛偆側偙偲偼側偐偭偨丅偙傟偼愇塸偺擬揱摫棪偑崅偄偨傔偱丄傾儖儈僫丒僔乕僩傗儅僌僱僔傾丒僙儊儞僩傪撪挘傝偵偟偰抐擬惈傪忋偘偰峴偆偲彮偟偼堘偆偲巚傢傟傞丅 乮YouTube偵偁傞傛偆側丄悈偱幖傜偣偨傠巻傪擇廳偵偟偰揰壩偡傞曽朄偱偼抐擬偑壜擻偱丄侾丏俇倗丄侽丏俇倗偺彮検偱傕揝偺嬍偑偱偒傞丅乯
丂

丂

丂丂偦偙偱俁夞栚偺幚尡偲偟偰丄愇塸傞偮傏乮俆侽們們乯偵傾儖儈僫僔乕僩偺撪挘傝傪偟丄掙偵偼愇塸僂乕儖傪晘偄偰丄懡彮抐擬惈傪忋偘偨丅乮俥倕2俷3丂侾俇倗丄丂俙倢丂俇丏俁倗乯丂堦晹偼梟偗偰嬍偵側偭偨丅
丂

丂丂乮俀乯丂摵僥儖儈僢僩 乮婋尟丒桳撆乯
丂丂巁壔戞擇摵乮巁壔摵乮嘦乯乯 俠倳俷 傪梡偄偨僥儖儈僢僩偼丄帠屘椺傕偁傞傛偆偵撪梕暔偑暚偒弌偟偰旕忢偵婋尟側偺偱丄崱夞偼 垷巁壔摵乮巁壔摵乮嘥乯乯 俠倳2俷 乮侾俇倗乯丄傾儖儈僯僂儉暣乮俀丏係倗乯傪梡偄偨丅丂偟偐偟偦傟偱傕堦弖偵斀墳偟偰丄撪梕暔偺傎偲傫偳偑暚弌偟偰丄梟偗偨摵偺棻偑暻柺偵偔偭偮偔掱搙偟偐巆傜側偐偭偨丅丂乮師夞偼丄偝傜偵嬥懏偺摵暣傪崿偤偰丄斀墳懍搙傪壓偘傞偙偲傪帋傒偨偄丅乯
丂丂丂丂丂丂俁 俠倳2俷丂亄丂俀 俙倢丂仺丂俇 俠倳丂亄丂俙倢2俷3
丂
